
As
proteínas são macromoléculas, isto é, moléculas grandes, constituídas por
unidades chamadas aminoácidos. Algumas propriedades importantes dos seres vivos
estão associadas a elas: a facilitação para a ocorrência de reações químicas
(enzimas), o transporte de oxigênio (hemoglobina), a transmissão de informações
(hormônios), a composição estrutural das células (membranas, túbulos, etc.), a
defesa orgânica (anticorpos) e assim por diante.
O
que distingue uma proteína da outra é o número de aminoácidos, o tipo de
aminoácidos e a sequência na qual eles estão ligados.
Todos
os aminoácidos possuem um átomo de carbono central, ao qual se ligam um grupo carboxila
(COOH), que confere caráter ácido, um grupo amina (NH2), que tem
caráter básico, um átomo de hidrogênio (H) e um radical (R), variável de um
aminoácido para outro.
O
radical R pode ser um átomo de hidrogênio, um grupo ou grupos mais complexos,
contendo carbono, hidrogênio, oxigênio, nitrogênio e enxofre.
Os
animais podem sintetizar aminoácidos a partir de açúcar, graças à transferência
do grupo NH2 das proteínas da dieta. Podem, ainda, transformar
alguns aminoácidos em outros. Todavia, existem alguns aminoácidos que não podem
ser produzidos pelos animais, e precisam ser conseguidos na alimentação. São os
aminoácidos essenciais. Aqueles que podem ser sintetizados nas células animais
são chamados aminoácidos naturais.
AS REAÇÕES DE SÍNTESE
E HIDRÓLISE DAS PROTEÍNAS

As
proteínas, ou cadeias polipeptídicas são formadas pela união entre aminoácidos.
As ligações entre os aminoácidos são denominadas ligações peptídicas e ocorrem entre o grupo carboxila de um
aminoácido e o grupo amina de outro aminoácido.
Para
o organismo aproveitar as proteínas como fonte de aminoácidos, deve ocorrer
ação enzimática na digestão das proteínas, que ocorre no estômago e no
intestino, para quebrar as ligações peptídicas.
Como
cada ligação peptídica é formada entre dois aminoácidos, uma proteína com 100 aminoácidos
apresentará 99 (noventa e nove) ligações peptídicas.
AS ESTRUTURAS DAS
PROTEÍNAS
O
número de aminoácidos é muito variável de uma proteína para outra, veja os
exemplos abaixo:
Insulina
bovina - 51 aminoácidos;
Hemoglobina
humana - 574 aminoácidos;
Desidrogenase
glutâmica - 8.300 aminoácidos.
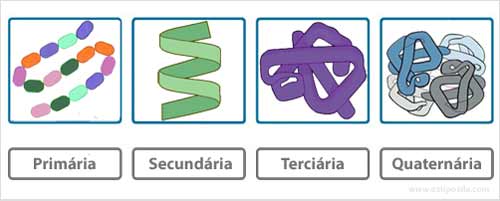
A
sequência linear de aminoácidos de uma proteína define sua estrutura primária.
O
filamento de aminoácidos se enrola ao redor de um eixo, formando uma escada
helicoidal chamada alfa-hélice. É uma estrutura estável, cujas voltas são
mantidas por ligações de hidrogênio. Tal estrutura helicoidal é a estrutura secundária da proteína.
As
proteínas estabelecem outros tipos de ligações entre suas partes. Com isto, dobram
sobre si mesmas, adquirindo uma configuração espacial tridimensional, chamada
estrutura terciária. Essa configuração pode ser filamentar como no colágeno, ou
globular, como nas enzimas.
Tanto
o estabelecimento de ligações de hidrogênio como o de outros tipos de ligações dependem
da sequência de aminoácidos que compõem a proteína. Uma alteração na sequência
de aminoácidos (estrutura primária) implica em alterações nas estruturas
secundária e terciária da proteína. Como a função de uma proteína se relaciona
com sua forma espacial, também será alterada.
Muitas
proteínas são formadas pela associação de dois ou mais polipeptídios (cadeias
de aminoácidos). A maneira como estas cadeias se associam constitui a estrutura quaternária dessas proteínas.
DESNATURAÇÃO DAS
PROTEÍNAS

Quando
as proteínas são submetidas à elevação de temperatura, a variações de pH ou a
certos solutos como a ureia, sofrem alterações na sua configuração espacial, e
sua atividade biológica é perdida. Este processo se chama desnaturação. Ao
romper as ligações originais, a proteína sofre novas dobras ao acaso.
Geralmente, as proteínas se tornam insolúveis quando se desnaturam.
Na
desnaturação, a sequência de aminoácidos não se altera e nenhuma ligação
peptídica é rompida. Isto demonstra que a atividade biológica de uma proteína
não depende apenas da sua estrutura primária, embora esta seja o determinante
da sua configuração espacial.
Algumas
proteínas desnaturadas, ao serem devolvidas ao seu meio original, podem recobrar
sua configuração espacial natural. Todavia, na maioria dos casos, nos processos
de desnaturação por altas temperaturas ou por variações extremas de pH, as
modificações são irreversíveis. Como é o caso da clara do ovo que se solidifica
e se torna branca, ao ser cozida, mas não se liquefaz nem volta a ser
transparente, quando esfria.
AS FUNÇÕES DAS
PROTEÍNAS

As proteínas
desempenham quatro funções importantes para os seres vivos:
As
proteínas estruturais estão presentes em estruturas esqueléticas, como ossos,
tendões e cartilagens, unhas, cascos, etc., além da membrana celular.
As
proteínas hormonais atuam no metabolismo como mensageiros químicos, como a
insulina e o glucagon que controlam a glicemia do sangue e o hormônio de
crescimento denominado somatotrofina, secretado pela hipófise.
As
proteínas de defesa imunológica são as imunoglobulinas (anticorpos).
As
proteínas de ação enzimática (enzimas) são importantes como catalisadores
biológicos favorecendo reações do metabolismo celular, como as proteases, a
catalase, a desidrogenase, entre outras.
ENZIMAS
As
enzimas são responsáveis por catalisar milhares de reações químicas que
constituem o metabolismo celular. Os catalisadores são substâncias que
interferem na velocidade de uma reação química, sem sofrer alteração. Como todo
catalisador, a enzima pode participar de uma reação várias vezes, podendo
realizar uma mesma reação química milhares de vezes por segundo.
Todas
as enzimas são proteínas. Portanto, sua produção é subordinada ao controle do
DNA. É através da produção de enzimas específicas que o DNA comanda todo o
metabolismo celular.
Sendo
proteínas, quando submetidas a fatores capazes de modificar sua configuração
espacial natural, podem perder suas propriedades catalíticas.
Algumas
enzimas só atuam quando ligadas a um outro composto, chamado cofator. O cofator
pode ser um metal (Zn, Fe, Mg, Mn, etc.) ou uma molécula orgânica designada por
coenzima. As vitaminas da dieta, geralmente, são coenzimas.
As
reações químicas ocorrem quando ligações químicas das moléculas reagentes são
rompidas e novas ligações são formadas, originando novas moléculas. Para que
aconteçam, as moléculas reagentes devem alcançar um nível de energia maior que
o normal (estado de transição). A energia necessária para elevar o nível
energético dos reagentes a este estado de transição é a energia de ativação.
Pode
ser comparada à energia necessária para levar uma pedra até o alto de uma
montanha, de onde irá rolar.
Na
presença de um catalisador, as moléculas atingem o estado de transição em um
nível energético inferior aquele que atingiriam na sua ausência. Portanto, os
catalisadores aumentam a velocidade da reação porque diminuem a energia de
ativação necessária. Quando os produtos são formados, o catalisador se desprende,
inalterado.
Quando
o catalisador é uma enzima, os reagentes são chamados substratos. O nome de uma
enzima pode indicar o tipo de reação catalisada (hidrolase, transaminase,
desidrogenase, etc.) ou substrato sobre o qual ela atua (amilase, protease,
lipase, etc.).
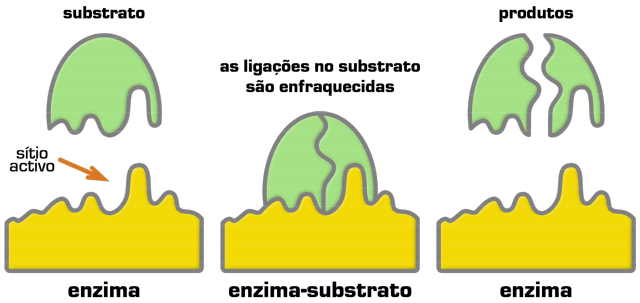
As
enzimas atuam oferecendo às moléculas dos substratos um local para aderirem e
aonde a reação irá se processar. Tal local é o centro ativo.
A
ligação entre o substrato e o centro ativo é muito precisa e específica. A
estrutura do centro ativo depende da configuração espacial da enzima.
Alterações na estrutura tridimensional da enzima podem torná-la inativa, por
impedir o encaixe do substrato no centro ativo. A ligação da enzima com seu
substrato tem, portanto, grande especificidade.
FATORES QUE MODIFICAM
A AÇÃO ENZIMÁTICA
Efeito da
concentração do substrato
A
enzima E combina-se com o substrato S, formando um complexo ES, em uma reação rápida.
Em uma reação mais lenta, o complexo ES se desfaz, originando o produto P e
liberando a enzima.
Se
a concentração da enzima for constante, aumentos sucessivos na concentração do substrato
são acompanhados por aumentos cada vez menores na velocidade da reação.
Atinge-se
um ponto no qual novos aumentos não provocarão elevação na velocidade. Ao ser
alcançada a velocidade máxima, a enzima encontra-se saturada e não pode atuar
mais rapidamente. Todas as moléculas da enzima encontram- se em atividade. Este
é um exemplo de saturação, onde a velocidade máxima da reação é alcançada,
conhecida como Constante de Michaelis
Menten.
EFEITO DA TEMPERATURA
Sabe-se
que a velocidade das reações químicas aumenta com a elevação da temperatura. Todavia,
nas reações catalisadas por enzimas, a velocidade tende a diminuir quando a temperatura
passa de 35°C a 40°C. Isso ocorre porque temperaturas elevadas alteram a estrutura
secundária, terciária e até quaternária da enzima, afetando sua configuração
espacial. Em temperaturas superiores a 70 °C as reações enzimáticas cessam para
os humanos, pois deve ocorrer desnaturação da enzima.
Existe,
portanto, uma temperatura na qual a atividade da enzima é máxima, a temperatura
ótima. Nos animais homeotérmicos, cuja temperatura corporal é constante, a
temperatura ótima está entre 35°C e 40 °C. Nos pecilotérmicos, de temperatura
variável, as enzimas atuam em temperatura de 25°C, aproximadamente.
As
enzimas não se tornam inativadas pelo congelamento. A velocidade das reações
diminui com a queda da temperatura, podendo mesmo cessar. Porém, a atividade
catalítica reaparece, quando a temperatura se eleva a valores normais. A
diminuição da atividade enzimática e da taxa metabólica em baixas temperaturas é
útil para o congelamento de sêmen e de embriões, para a conservação de órgãos
para transplantes ou para a preservação de órgãos durante a realização de
cirurgias.
EFEITO DO PH
As
enzimas têm um pH ótimo no qual sua atividade biológica é máxima. Em valores
abaixo (mais ácido) ou acima (mais básico) desse pH, a atividade biológica
diminui porque a estrutura tridimensional da enzima se altera. O pH ótimo varia
de enzima para enzima.
God bless you!
See you later. Take care!


��������
ResponderExcluir